Deze blog werd oorspronkelijk gepubliceerd in Neuron vol 25 nr. 3, p. 24-27 (www.neuron.be)
Opm. De oorspronkelijke paper [Van Schependom et al., 2019] is gratis beschikbaar. Niet alle referenties konden in deze samenvatting opgenomen worden.
Samenvatting
Multiple sclerose is een complexe ziekte van het centraal zenuwstelsel die wordt gekenmerkt door chronische processen van ontsteking en neurodegeneratie. Een versnelde afname van hersenvolume, ook wel atrofie genoemd, is recent een populaire merker van neurodegeneratie geworden. Het nadeel van deze merker is dat hij enkel gemeten kan worden als er al onherroepelijke hersenschade opgetreden is. Daarom kan het afstellen van behandelingsstrategieën die hierop gebaseerd zijn als suboptimaal beschouwd worden. In dit overzichtsartikel bekijken we verschillende technieken die neurodegeneratieve processen kunnen detecteren vooraleer er substantiële atrofie optreedt.
Overzicht
Eerst en vooral zijn er metabole en moleculaire merkers die vroege subcellulaire veranderingen opsporen. Een tweede mogelijkheid is het aantonen van cerebrale hypoperfusie. Er zijn aanwijzingen voor cerebrale hypoperfusie in het volledige klinische spectrum van MS. Het is echter onduidelijk of dit een gevolg is van verminderde metabole activiteit dan wel of dit een onafhankelijk proces is dat kadert in de pathologie van MS. Als derde mogelijkheid kunnen netwerkveranderingen in hersenstructuur en functie gemeten worden via structurele en functionele beeldvorming. Tot slot, kunnen verhoogde waarden van neurofilamenten in serum of cerebrospinaal vocht een voorbode zijn van hersenatrofie.
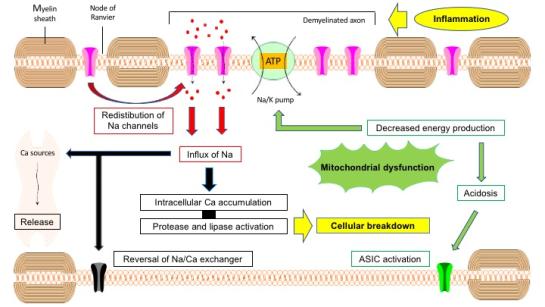
Figuur 1. Cascade van verschillende processen die inflammatie kunnen linken aan progressive neurodegeneratie in multiple sclerose. Oorspronkelijke figuur kan teruggevonden worden in [Van Schependom et al., 2019]
Moleculaire en metabole beeldvorming
Van inflammatie naar neurodegeneratie
De eerste stap in het zoeken naar merkers die atrofie voorafgaan, is het identificeren van de verschillende biologische processen in de aanloop naar neuronale celdood. Het exacte ziekteproces is echter nog niet duidelijk. Doorgaans wordt er van uit gegaan dat auto-reactieve lymfocyten het centraal zenuwstelsel infiltreren en daar de kenmerkende demyeliniserende letsels veroorzaken. Bij de vorming van letsels kan het axon beschadigd worden. Via anterograde en retrograde degeneratie kan dit leiden tot neuronale degeneratie. Onderzoek toont evenwel aan dat de meeste axonen deze acute ontstekingsreactie overleven.
Het is waarschijnlijk de chronische demyelinisatie die verantwoordelijk is voor het gestaag afsterven van de zenuwcellen, wanneer initiële compenserende strategieën falen. De belangrijkste factoren in het proces van axonale degeneratie zijn oxidatieve stress, mitochondriaal falen, energie falen en ionendysregulatie.
Chronische demyelinisatie leidt tot een herdistributie van natrium (Na) kanalen langsheen het axolemma. Na-kanalen die onder normale omstandigheden geconcentreerd zouden blijven in de knopen van Ranvier. Extracellulair Na zal dan eenvoudiger kunnen migreren door deze kanalen wat impliceert dat de energie verslindende Na/Kalium pomp harder zal moeten werken om de correcte ionenconcentraties te behouden.
Voor hun energieproductie hangen axonen sterk af van mitochondriën die op hun beurt gevoelig zijn aan oxidatieve stress die gepaard gaat met ontstekingsreacties. Daardoor is er dus een verhoogde behoefte aan energie enerzijds en een verminderd functioneren van de mitochondriën anderzijds. De verhoogde concentratie aan mitochondriën in chronische inactieve letsels is waarschijnlijk een initiële compensatie. Eens de oxidatieve stress te groot wordt, kunnen we aannemen dat de energie productie niet meer voldoet. Als gevolg van dit energie tekort vertraagt de Na/K pomp en is er bijgevolg een ophoping van Na in de cel, wat op zijn beurt leidt tot een ophoping van intracellulair calcium (Ca) door de omkering van de Na/Ca wisselaar en de vrijstelling van Ca uit het endoplasmatisch reticulum. Een te hoge intracellulaire concentratie van Ca wordt op zich gezien als een pad naar celdood.
Naast deze processen zijn er nog enkele versterkende mechanismen: het falen van de Na/K pomp zal ook leiden tot intracellulaire acidose wat leidt to supplementair Na en Ca in de cel. Intracellulaire opstapeling van Ca kan op zich leiden tot een verhoogde Na influx door andere ionkanalen te openen met celzwelling tot gevolg en het hele proces van mitochondriale en diffuse structurele schade zal nog meer oxidatieve stress genereren.
Moleculaire en metabole beeldvorming laten toe om deze subcellulaire veranderingen in de witte en grijze stof in beeld te brengen zelfs wanneer deze er op standaard magnetische resonantie beeldvorming normaal lijken uit te zien.
Mitochondriaal falen
Mitochondriaal falen kan gemeten worden aan de hand van N-acetyl-aspartaat (NAA), aangezien NAA bijna exclusief door mitochondriën wordt aangemaakt. In acute MS letsels is de NAA concentratie lager dan in de omliggende witte stof en dan in de witte stof van gezonde controles. Hoewel dit misschien gedeeltelijk verklaard worden door oedeem, is een gelijkaardige reductie ook opgemeten in chronische letsels.
Er zijn weinig longitudinale studies die zowel NAA-concentraties als atrofie opmeten, maar één studie toonde alvast een normalisatie van NAA concentraties aan, mogelijk een compensatie strategie van de resterende mitochondrieën, die samenging met een afname van hersenvolume. We kunnen dus spreken van een tijdlijn die begint met een afname in NAA concentratie en gevolgd wordt door een afname in hersenvolume [Ciccarelli et al., 2010].
Natrium opstapeling
De opstapeling van intracellulair Na is een belangrijke stap in de voorgestelde cascade van het neurodegeneratieve proces in MS. In gezond hersenweefsel wordt de Na concentratie actief laag gehouden in het intracellulair volume in tegenstelling tot de hogere concentratie in het kleinere extracellulair volume. De totale Na concentratie kan in beeld gebracht worden in standaard MRI scanners en verschillende groepen toonden een verhoogde concentratie van Na aan in letsels, alsook in (normaal uitziende) witte stof en in corticale en diepe grijze stof. Hogere Na concentraties lijken ook gecorreleerd te zijn met een actieve ziekte en grotere handicap.
Aangezien de vorige studies de totale Na concentratie maten, zou een verhoogde Na concentratie ook te wijten kunnen zijn aan een uitbreiding van de extracellulaire ruimte ten gevolge van atrofie. Echter, abnormaal hoge Na concentraties zijn ook gevonden in grijze stof van MS patiënten zonder atrofie.
Tot slot, een belangrijke bijdrage in de richting van Na als merker komt van meer geavanceerde MRI scanners die zowel intracellulaire als totale Na concentratie kunnen meten. In een eerste kleine studie werd daarmee ook een verhoging van intracellulair Na opgemeten [Petracca et al., 2016].
Intracellulaire acidose
Zowel acute inflammatie als chronisch energie falen kunnen resulteren in intracellulaire acidose. Een verhoogde intracellulaire acidose kan opgemeten worden met amide-proton transfer (APT) beeldvorming. Hoewel in een recente studie veranderingen in APT werden opgemeten in MS patiënten, verhindert de sterke variatie met acquisitie parameters de klinische toepassing van APT beeldvorming in de klinische praktijk.
Positron emissie tomografie (PET)
Aan de hand van PET, kunnen verschillende liganden in beeld gebracht worden. Het meest gebruikte ligand fluorodeo/radio-isotoop is xyglucose (FDG) die de snelheid van glucose consumptie opmeet. Zowel een verhoging (verhoogde energie nood) als een verlaging in FDG (verminderde neuronale integriteit) zijn al opgetekend.
Een ander ligand is 11C-flumazenil dat selectief bindt aan de benzodiazepine site van GABA-A receptoren. Freeman en collega’s hebben recent een verminderde 11C-flumazenil binding aangetoond in een gemengd cohort van relapsing remitting en progressieve MS patiënten [Freeman et al., 2015]. Dit effect was ook zichtbaar in de groep van relapsing remitting patiënten zonder atrofie. De relatie tussen GABA-synapsen en metabolische dysfunctie is momenteel onbekend, maar deze bevindingen wijzen er wel op dat er detecteerbare veranderingen zijn in een klinisch relevant stadium.
Cerebrale hypoperfusie
Hypoperfusie in MS
Aangezien hersendoorbloeding actief gereguleerd wordt, kan men een verminderde hersendoorbloeding verwachten wanneer er minder energie verbruikt wordt. Verschillende studies hebben ook effectief een verminderde hersendoorbloeding van de witte stof vastgesteld in multiple sclerose.
Het exacte mechanisme van cerebrale hypoperfusie in MS is echter nog onduidelijk. Een recente studie toonde aan dat de verandering in perfusie meer compatibel waren met een primaire ischemie dan met secundaire hypoperfusie als gevolg van een verminderde energienood [Saindane et al., 2007]. Deze hypothese werd verder versterkt door een studie waarbij zowel hersendoorbloeding als NAA niveau werd opgemeten: hier vond men zowel een verminderd NAA niveau als een verminderde hersendoorbloeding in het centrum semiovale. De verhouding NAA/hersendoorbloeding was echter wel significant hoger in de MS groep. Dit suggereert dat de vermindering in hersendoorbloeding sterker was dan wat te verwachten zou zijn op basis van de vermindering van energie consumptie [Steen et al., 2013].
Hypoperfusie: een actief ziekte proces?
Het idee dat hypoperfusie een actieve rol speelt in het ziekteproces van MS is een speculatief maar intrigerend idee. Hoewel prospectieve longitudinale data nog altijd ontbreken, hebben verschillende cross-sectionele studies aangetoond dat er een verminderde hersendoorbloeding is in hersenregio’s zonder atrofie
Connectiviteitsveranderingen
Hoewel sommige neurologische functies gelokaliseerd kunnen worden in specifieke hersenregio’s, zijn andere functies moeilijker te lokaliseren omdat ze de integratie van informatie over verschillende hersenregio’s vereisen. Verschillende neurodegeneratieve aandoeningen leiden tot disrupties van deze netwerken en zo ook tot cognitieve problemen.
Functionele connectiviteit
De activatie van verschillende hersenregio’s verhoogt de zuurstofconsumptie en verhoogt ook de doorbloeding van diezelfde regio’s. Deze verhoging kan opgemeten worden aan de hand van functionele MRI (fMRI). FMRI kan opgemeten worden wanneer subjecten ofwel een specifieke taak aan het uitvoeren zijn ofwel zonder taak (‘in rust’). Over het algemeen vertonen mensen met een klinisch geïsoleerde syndroom of MS met een ziekteduur minder dan 2 jaar een verhoogde functionele connectiviteit en vertonen MS patiënten met een langere ziekteduur een verlaagde connectiviteit. Deze bevindingen lijken te wijzen op een omgekeerde U-curve tussen ziekteduur en integratie tussen verschillende hersenzone’s.
Structurele connectiviteit
De structurele connectiviteit kan opgemeten worden aan de hand van diffusie tensor beeldvorming en laat toe om per voxel (typisch een kubus met zijde 1 of 2 mm) de hoofdrichting van de diffusie van water te bepalen. Deze hoofdrichting is dan een benaderings voor de hoofdrichting van de axonen. Per voxel worden dan verschillende parameters bepaalde zoals fractionele anisotropie (een maat voor isotropie; 0=isotroop; 1=anisotroop) en gemiddelde diffusiviteit (lagere waarden wijzen op een kleinere diffusie). Hoewel diffusie beeldvorming studies tegenstrijdige resultaten hebben gegeven, zijn de verschillende parameters gevoelig voor farmaceutische interventies.
Lichaamsvocht merkers
Hoewel verschillende merkers onderzocht zijn, worden er in de klinische praktijk maar twee gebruikt: de aanwezigheid van oligoclone banden en een verhoogde IgG index, beiden opgemeten in het cerebrospinaal vocht (CSV).
Een veel belovend alternatief is neurofilament-light-chain. Neurofilamenten zijn overvloeding en exclusief aanwezig in de opbouw van het cytoskelet van neuronen en zijn dus een uitstekende kandidaat voor het opmeten van axonale schade. NF-L kan opgemeten worden in CSV, en sinds kort ook in het bloed. Verhoogde niveaus van NF-L zijn niet alleen opgemeten in MS, maar ook in andere degeneratieve aandoeningen.
Momenteel zijn we echter niet op de hoogte van studies die veranderde NF-L waarden laten zien in de afwezigheid van hersenatrofie.
Discussie
Ondanks de groeiende beschikbaarheid van partieel effectieve therapieën, blijft multiple sclerose een onvoorspelbare en ongeneeslijke ziekte. Het kunnen meten van hersenvolumes is een belangrijke stap in de opvolging van het ziekteverloop. Het optreden van hersenatrofie duidt echter wel op onomkeerbare schade aan de hersenen.
In dit artikel hebben we kandidaat biomerkers beschreven die kunnen toelaten om neurodegeneratieve ziekteprocessen op te volgen vooraleer er onomkeerbare schade is. Het is daarbij belangrijk om op te merken dat het voorgestelde pathologische model hypothetisch blijft. MS is een extreem complexe pathologie en diverse pathologische processen kunnen (ook) neuronale degeneratie kunnen uitlokken. Daarnaast is het onzeker of therapeutische beslissigen gebaseerd op geavanceerde MRI of biochemische merkers ooit zullen leiden tot betere klinische resultaten; het valt niet uit te sluiten dat subcellulaire schade een point-of-no-return bereikt vooraleer we veranderingen kunnen detecteren.
Jeroen Van Schependom; Kaat Guldolf; Marie B D’hooghe; Guy Nagels; Miguel D’haeseleer
Referenties
Ciccarelli O, Altmann DR, McLean MA, Wheeler-Kingshott CA, Wimpey K, Miller DH, Thompson AJ (2010): Spinal cord repair in MS: Does mitochondrial metabolism play a role? Neurology 74:721–727.
Freeman L, Garcia-Lorenzo D, Bottin L, Leroy C, Louapre C, Bodini B, Papeix C, Assouad R, Granger B, Tourbah A, Dollé F, Lubetzki C, Bottlaender M, Stankoff B (2015): The neuronal component of gray matter damage in multiple sclerosis: A [ 11 C]flumazenil positron emission tomography study. Ann Neurol 78:554–567.
Petracca M, Vancea RO, Fleysher L, Jonkman LE, Oesingmann N, Inglese M (2016): Brain intra- and extracellular sodium concentration in multiple sclerosis: A 7 T MRI study. Brain 139:795–806.
Saindane AM, Law M, Ge Y, Johnson G, Babb JS, Grossman RI (2007): Correlation of Diffusion Tensor and Dynamic Perfusion MR Imaging Metrics in Normal- Appearing Corpus Callosum: Support for Primary Hypoperfusion in Multiple Sclerosis. Am J Neuroradiol 28:767–772.
Van Schependom J, Guldolf K, D’Hooghe MB, Nagels G, D’Haeseleer M (2019): Detecting neurodegenerative pathology in multiple sclerosis before irreversible brain tissue loss sets in. Transl Neurodegener 8:1–17.
Steen C, D’haeseleer M, Hoogduin JM, Fierens Y, Cambron M, Mostert JP, Heersema DJ, Koch MW, De Keyser J (2013): Cerebral white matter blood flow and energy metabolism in multiple sclerosis. Mult Scler 19:1282–9.